X

Página inicial
Información adicional:
Enlaces:
UCCE Almond Newsletters:

Guía de fertilización en California
Almendros
Javascript is disabled on your browser. For full functionality of this site it is necessary to enable JavaScript. Follow this link for instructions on how to enable JavaScript in your web browser.
Árboles
jovenes
jovenes
Dormancia
Invierno
Invierno
Floración
Primavera
Primavera
Desarrollo de las
frutas Verano
frutas Verano
Posterior a la Cosecha
Otoño
Otoño
Inicio de la pagina
Referencias:
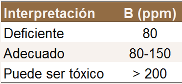
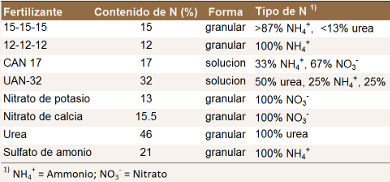
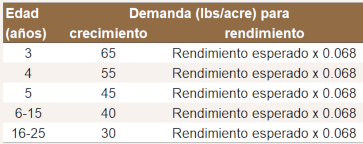
Nitrógeno
- Beutel, J., Uriu, K., Lilleland, O., 1976. Leaf analysis for California deciduous fruits. In: Reisenauer, H.M. (Ed.) Soil and Plant-Tissue Testing in California. University of California Cooperative Extension Bulletin 1879. pp. 15-17.
- Brown, P., 2009. Are critical values for nutrient management in almond and pistachio orchards invalid? Fluid Journal 17(3), Issue #65.
- Brown, P., 2012. Presentation held at the 40th Almond Conference in Sacramento. December 12, 2012.
- Brown, P.H., Uriu, K., 1996. Nutrition deficiencies and toxicities: Diagnosing and correcting imbalances. In: Micke, W.C. (Ed.) Almond Production Manual. University of California, Division of Agriculture and Natural Resources, Publication 3364. pp. 179-188.
- Brown, P.H., Weinbaum, S.A., Zhang, Q., 1999. Development of a nitrogen fertilizer recommendation model to improve N-use efficiency and alleviate nitrate pollution to groundwater from almond orchards. FREP Final Report.
- Brown, P.H., Muhammad, S., Saa Silva, S., 2012a. Update 2012: Fertigation trials in almond.
- Brown, P.H., Saa Silva, S., Muhammad, S., 2012b. Development of leaf sampling interpretation methods for almond and development of a nutrient budget approach to fertilizer management in almond. Almond Board of California Final Research Report.
- Brown P., Muhammad, S., Saa Silva, S. Development of Leaf Sampling Methods & Nutrient-Budget Fertilization.
- Brown, P.H., Saa, S., Muhammad, S., Khalsa, S.D., 2020. Nitrogen Best Management Practices.
- Buchner, P.B., 2011. Nitrogen contribution from irrigation water. Pomology Notes Cooperative Extension Colusa-Sutter-Yuba Counties, Spring 2011. pp. 5-6.
- Doll, D., 2010a. Tips for maximizing nitrogen use efficiency for almond.
- Doll, D., 2010b. April/May/June almond nut development – rationale for proper irrigation and fertilization.
- Doll, D., 2011a. Fertilizing young almond trees – a few tips.
- Doll, D., 2011b. Some early season thoughts.
- Doll, D., 2012a. Regional considerations for nitrogen timing.
- Doll, D., 2012b. Post harvest nitrogen: How much?
- Doll, D., 2012c. Nitrogen and potassium leaf content: Is there such thing as too much?
- Doll, D., 2012d. Presentation held at the 40th Almond Conference in Sacramento. December 12, 2012.
- Duncan, R. Fall urea sprays.
- Duncan, R. Fall foliar urea for bacterial canker management.
- Holtz, B., 2010. Fertilizing one-year old trees – Be careful!
- Klein, I., Weinbaum, S.A., 1985. Foliar application of urea to almond and olive: Leaf retention and kinetics of uptake. Journal of Plant Nutrition 8, 117-129.
- Meyer, R.D., 2004. Nitrogen on drip irrigated almonds. In: Almond Board of California (Ed.) Years of Discovery. A compendium of production and environmental research projects 1972-2003. pp. 284-285.
- Meyer, R.D., Deng, J., Edstrom, J.P., Cutter, S., 1998. Foliar nutrient (N, P, K, B) application effects on almond yields. Acta Horticulturae 470, 406-411.
- Morgan, K.T., Wheaton, T.A., Castle, W.S., Parson, L.R., 2009. Response of young and maturing citrus trees grown on a sandy soil to irrigation scheduling, nitrogen fertilizer rate, and nitrogen application method. HortScience 44, 145-150.
- Niederholzer, F., 2011. Using urea efficiently.
- Niederholzer, F., 2012a. Nitrogen use efficiency in almonds. Sacramento Valley Almond News, April 2012.
- Niederholzer, F., 2012b. Summer leaf sampling is serious business.
- Saa Silva, S., Muhammad, S., Sanden, B., Laca, E., Brown, P., 2012. Almond early-season sampling and in-season nitrogen maximizes productivity, minimizes loss.
- Weinbaum, S.A., Goldhamer, D.A.,1995. Nitrogen fertilizer management to reduce groundwater degradation. FREP Final Report.
- Weinbaum, S.A., Muraoka, T.T., 1986. Nitrogen redistribution from almond foliage and pericarp to the almond embryo. Journal of the American Society for Horticultural Science 111, 224-228.
- Weinbaum, S.A., Klein, I., Broadbent, F.E., Micke, W.C., Muraoka, T.T., 1984. Use of isotopic nitrogen to demonstrate dependence of mature almond trees on annual uptake of soil nitrogen. Journal of Plant Nutrition 7, 975-990.
- Weinbaum, S.A., Micke, W.C., Prichard, T.L., 1996. Nitrogen usage. In: Micke, W.C. (Ed.) Almond Production Manual. University of California, Division of Agriculture and Natural Resources, Publication 3364. pp. 189-195.
- Teviotdale, B.L., 1996. Effects of four levels of applied nitrogen on three fungal diseases of almond trees. FREP Final Report.
- Zasosky, R.J., 1994. Nitrogen efficiency in drip irrigated almonds. FREP Final Report.
Inicio de la pagina
Fosforo
- Ben-Asher, J., Cardon, G., Peters, D., Rolston, D.E., Phene, C.J., Biggar, J.W., Hutmacher, R.B., 1994. Determining almond root zone from surface carbon dioxide fluxes. Soil Science Society of America Journal 58, 930-934.
- Beutel, J., Uriu, K., Lilleland, O., 1976. Leaf analysis for California deciduous fruits. In: Reisenauer, H.M. (Ed.) Soil and Plant-Tissue Testing in California. University of California Cooperative Extension Bulletin 1879. pp. 15-17.
- Brown, P.H., Uriu, K., 1996. Nutrition deficiencies and toxicities: Diagnosing and correcting imbalances. In: Micke, W.C. (Ed.) Almond Production Manual. University of California, Division of Agriculture and Natural Resources, Publication 3364. pp. 179-188.
- Brown, P.H., Muhammad, S., Saa Silva, S., 2012a. Update 2012: Fertigation trials in almond.
- Brown, P.H., Saa Silva, S., Muhammad, S., 2012b. Development of leaf sampling interpretation methods for almond and development of a nutrient budget approach to fertilizer management in almond. Almond Board of California Final Research Report.
- California Plant Health Association, 2002. Western Fertilizer Handbook 9th edition. Interstate Publishers, Inc.
- Carlson, R.M., 1996. Nutrients in the soil. In: Micke, W.C. (Ed.) Almond Production Manual. University of California, Division of Agriculture and Natural Resources, Publication 3364. pp. 116-120.
- Doll, D., 2011a. Fertilizing young almond trees – a few tips.
- Franco, J.A., Abrisqueta, J.M., 1997. A comparison between minirhizotron and soil coring methods of estimating root distribution in young almond trees under trickle irrigation. Journal of Horticultural Science 72, 797-805.
- Fulton, A., 2010. Understanding and applying information from a soil test: Part 2 – NPK.
- Holtz, B., 2010. Fertilizing one-year old trees – Be careful!
- Meyer, R.D., Deng, J., Edstrom, J.P., Cutter, S., 1998. Foliar nutrient (N, P, K, B) application effects on almond yields. Acta Horticulturae 470, 406-411.
- Niederholzer, F., 2012b. Summer leaf sampling is serious business.
- Saa Silva, S., Muhammad, S., Sanden, B., Laca, E., Brown, P., 2012. Almond early-season sampling and in-season nitrogen maximizes productivity, minimizes loss.
- Saura-Calixto, F., Cañellas, J., 1981. Mineral composition of almond varieties (Prunus amygdalus) Zeitschrift fuer Lebensmittel-Untersuchung und -Forschung. 174, 129-131.
- Saura-Calixto, F., Cañellas, J., Garcia-Raso, J., 1983. Contents of detergent-extracted dietary fibers and composition of hulls, shells, and teguments of almonds (Prunus amygdalus). Journal of Agriculltural and Food Chemistry 31, 1255-1259.
- Weinbaum, S.A., Micke, W.C., Prichard, T.L., 1996. Nitrogen usage. In: Micke, W.C. (Ed.) Almond Production Manual. University of California, Division of Agriculture and Natural Resources, Publication 3364. pp. 189-195.
Potasio
- Basile, B., Reidel, E.J., Weinbaum, S.A., DeJong, T.M., 2003. Leaf potassium concentration, CO2 exchange and light interception in almond trees (Prunus dulcis (Mill) D.A. Webb). Scientia Horticulturae 98, 185–194.
- Ben-Asher, J., Cardon, G., Peters, D., Rolston, D.E., Phene, C.J., Biggar, J.W., Hutmacher, R.B., 1994. Determining almond root zone from surface carbon dioxide fluxes. Soil Science Society of America Journal 58, 930-934.
- Beutel, J., Uriu, K., Lilleland, O., 1976. Leaf analysis for California deciduous fruits. In: Reisenauer, H.M. (Ed.) Soil and Plant-Tissue Testing in California. University of California Cooperative Extension Bulletin 1879. pp. 15-17.
- Brown, P.H., Uriu, K., 1996. Nutrition deficiencies and toxicities: Diagnosing and correcting imbalances. In: Micke, W.C. (Ed.) Almond Production Manual. University of California, Division of Agriculture and Natural Resources, Publication 3364. pp. 179-188.
- Brown, P.H., Weinbaum, S.A., Zhang, Q., 1999. Development of a nitrogen fertilizer recommendation model to improve N-use efficiency and alleviate nitrate pollution to groundwater from almond orchards. FREP Final Report.
- Brown, P.H., Muhammad, S., Saa Silva, S., 2012a. Update 2012: Fertigation trials in almond.
- Brown, P.H., Saa Silva, S., Muhammad, S., 2012b. Development of leaf sampling interpretation methods for almond and development of a nutrient budget approach to fertilizer management in almond. Almond Board of California Final Research Report.
- Brown, P.H., Zhang, Q., Stevenson, M., Rosecrance R.C. Almond Nitrogen Model.
- Carlson, R.M., 1996. Nutrients in the soil. In: Micke, W.C. (Ed.) Almond Production Manual. University of California, Division of Agriculture and Natural Resources, Publication 3364. pp. 116-120.
- Connell, J., 2010. Late fall, a time for potassium soil applications.
- Doll, D., 2009. Potassium thiosulfate toxicity on almond.
- Doll, D., 2011a. Fertilizing young almond trees – a few tips.
- Doll, D., 2011c. Almond potassium fertilization: where did my potassium go?
- Duncan, R. Potassium deficiency.
- Edstrom, J.P., Meyer, R.D., Deng, J., 2008. Potassium fertilizer application in drip and micro-jet irrigated almonds. Acta Horticulturae 792, 257-263.
- Franco, J.A., Abrisqueta, J.M., 1997. A comparison between minirhizotron and soil coring methods of estimating root distribution in young almond trees under trickle irrigation. Journal of Horticultural Science 72, 797-805.
- Fulton, A., 2010. Understanding and applying information from a soil test: Part 2 – NPK.
- Holtz, B., 2010. Fertilizing one-year old trees – Be careful!
- Meyer, R.D., Deng, J., Edstrom, J.P., Cutter, S., 1998. Foliar nutrient (N, P, K, B) application effects on almond yields. Acta Horticulturae 470, 406-411.
- Micke, W., 2004. Almond culture and orchard management. In: Almond Board of California (Ed.) Years of Discovery. A compendium of production and environmental research projects 1972-2003. pp. 317-331.5
- Niederholzer, F., 2012b. Summer leaf sampling is serious business.
- Reidel, E.J., Brown P.H., Duncan, R.A., Weinbaum, S.A., 2001. Almond productivity as related to tissue potassium. Better Crops 85, 21-23.
- Reidel, E.J., Brown P.H., Duncan, R.A., Heerema, R.J., Weinbaum, S.A., 2004. Sensitivity of yield determinants to potassium deficiency in ‘Nonpareil’ almond (Prunus dulcis (Mill.) D.A.Webb). Journal of Horticultural Science & Biotechnology 79, 906–910.
- Saa Silva, S., Muhammad, S., Sanden, B., Laca, E., Brown, P., 2012. Almond early-season sampling and in-season nitrogen maximizes productivity, minimizes loss.
- Saura-Calixto, F., Cañellas, J., 1981. Mineral composition of almond varieties (Prunus amygdalus) Zeitschrift fuer Lebensmittel-Untersuchung und -Forschung. 174, 129-131.
- Saura-Calixto, F., Cañellas, J., Garcia-Raso, J., 1983. Contents of detergent-extracted dietary fibers and composition of hulls, shells, and teguments of almonds (Prunus amygdalus). Journal of Agriculltural and Food Chemistry 31, 1255-1259.
- Weinbaum, S.A., Micke, W.C., Prichard, T.L., 1996. Nitrogen usage. In: Micke, W.C. (Ed.) Almond Production Manual. University of California, Division of Agriculture and Natural Resources, Publication 3364. pp. 189-195.
Inicio de la pagina
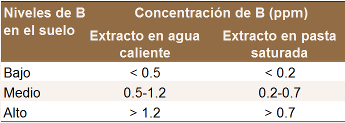
Boro
- Brown, P.H., 2004. Salinity and boron effects on almond under trickle irrigation. In: Almond Board of California (Ed.) Years of Discovery. A compendium of production and environmental research projects 1972-2003. pp. 272-273.
- Brown, P.H. Hu, H., 1996. Phloem mobility of boron is species dependent: Evidence for phloem mobility in sorbitol-rich species. Annals of Botany 77, 497-505.
- Brown, P.H., Uriu, K., 1996. Nutrition deficiencies and toxicities: Diagnosing and correcting imbalances. In: Micke, W.C. (Ed.) Almond Production Manual. University of California, Division of Agriculture and Natural Resources, Publication 3364. pp. 179-188.
- California Plant Health Association, 2002. Western Fertilizer Handbook 9th Edition. Interstate Publishers, Inc.
- Castro, J., Sotomayor, C., 1998. The influence of boron and zinc sprays at bloomtime on almond fruit set. Acta Horticulturae 470, 402-405.
- Doll, D., 2009. Post-harvest boron applications can increase almond yields.
- Doll, D., 2012. High boron hull and leaf values…
- Duncan, R., 2010. Hull samples for boron analysis.
- Duncan, R., 2012. Hull analysis for boron – why?
- Fulton, A., 2011. Understanding and applying information from a soil test: Part 4. University of California Cooperative Extension Colusa-Sutter-Yuba Counties Pomology Notes, April 2011, 1-2.
- Hansen, C.J., Kester, D.E., Uriu, K., 1962. Boron deficiency symptoms identified in almonds. California Agriculture 16, 6-7.
- Krueger, B., 2010. Fall nutrition management. University of California Cooperative Extension Tehama County Fruit and Nut Notes, November 2010, 5.
- Meyer, R.D., Deng, J., Edstrom, J.P., Cutter, S., 1998. Foliar nutrient (N, P, K, B) application effects on almond yields. Acta Horticulturae 470, 406-411.
- Niederholzer, F., 2010. Commercial almond nutrition program at Nickels Soils Lab. University of California Cooperative Extension Colusa-Sutter-Yuba Counties Pomology Notes, April 2010, 2-4.
- Niederholzer, F., 2012. Fall foliar fertilizers: Targeted v/s general approach.
- Nyomora, A.M.S., Brown, P.H., Freeman, M., 1997. Fall foliar-applied boron increases tissue boron concentration and nut set of almond. Journal of the American Society of Horticultural Science 122, 405–410.
- Nyomora, A.M.S., Brown, P.H., Krueger, B., 1999. Rate and time of boron application increase almond productivity and tissue boron concentration. Hortscience 34, 242–245.
- Nyomora, A.M.S., Brown, P.H., Pinney, K., Polito, V.S., 2000. Foliar application of boron to almond trees affects pollen quality. Journal of the American Society of Horticultural Science 125, 265–270.
- Peryea, F.J., Lageschulte, J.M., 2000. Boron fertilizer product and concentration influence spray water pH. HortTechnology 10, 350-353.




 Quemadura del ápice foliar en hojas de almendro
almendros "Butte" causada por la aplicación de urea. Las hojas fueron
muestreadas después de una aplicación de post-cosecha (Octubre) de una
solución de 5.4% de urea la cual contenia 20 lbs N/100 galones de agua (foto
proporcionada por Franz Neiderholzer).
Quemadura del ápice foliar en hojas de almendro
almendros "Butte" causada por la aplicación de urea. Las hojas fueron
muestreadas después de una aplicación de post-cosecha (Octubre) de una
solución de 5.4% de urea la cual contenia 20 lbs N/100 galones de agua (foto
proporcionada por Franz Neiderholzer).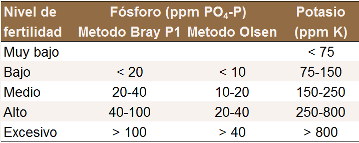
 Síntomas de deficiencia de
potasio en hojas de almendro (foto proporcionada por el
the
Síntomas de deficiencia de
potasio en hojas de almendro (foto proporcionada por el
the 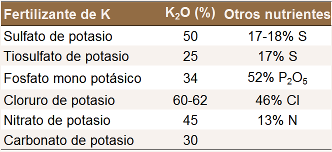
 Exudados
en almendras causados por deficiencia de boro (Foto proporcionada por
Patrick Brown).
Exudados
en almendras causados por deficiencia de boro (Foto proporcionada por
Patrick Brown).